TODO LO QUE PUEDE INTERESAR SOBRE LAS CÉLULAS MADRE (1)
 [Se condensan en dos artículos, éste y el siguiente (## 196 y 197), diez lecciones que aparecen publicadas en Arvo.net, sobre casi todo lo que puede interesar conocer para moverse con soltura en el actual debate social y mediático sobre las células madre. Las autoras son Natalia López Moratalla, Catedrática de Bioquímica, e Iranzu González de la Tajada, Profesora Ayudante de Histología (Universidad de Navarra). Pocas veces ha saltado un tema con tanta fuerza de las revistas científicas a los medios de comunicación. Los periódicos, la radio y la televisión recogen noticias sobre las células madre. Raro es el día en el que no aparece alguna noticia relacionada con reales o supuestos logros en la investigación con células madre embrionarias o adultas, aunque de este segundo tipo se habla más bien poco, focalizando la cuestión en las embrionarias.
[Se condensan en dos artículos, éste y el siguiente (## 196 y 197), diez lecciones que aparecen publicadas en Arvo.net, sobre casi todo lo que puede interesar conocer para moverse con soltura en el actual debate social y mediático sobre las células madre. Las autoras son Natalia López Moratalla, Catedrática de Bioquímica, e Iranzu González de la Tajada, Profesora Ayudante de Histología (Universidad de Navarra). Pocas veces ha saltado un tema con tanta fuerza de las revistas científicas a los medios de comunicación. Los periódicos, la radio y la televisión recogen noticias sobre las células madre. Raro es el día en el que no aparece alguna noticia relacionada con reales o supuestos logros en la investigación con células madre embrionarias o adultas, aunque de este segundo tipo se habla más bien poco, focalizando la cuestión en las embrionarias.  Muchas veces sorprende que las noticias —y las interpretaciones— estén tiznadas por juicios descalificadores contra quien, con toda racionalidad y justicia, manifieste su rechazo frente a la manipulación de embriones humanos, aunque se envuelva con sutiles disquisiciones (cfr. # 195) .
Muchas veces sorprende que las noticias —y las interpretaciones— estén tiznadas por juicios descalificadores contra quien, con toda racionalidad y justicia, manifieste su rechazo frente a la manipulación de embriones humanos, aunque se envuelva con sutiles disquisiciones (cfr. # 195) .¿Qué hay detrás de las células madre? ¿Qué son? ¿Cómo se pueden obtener? ¿Por qué, en medio de la esperanza que prometen, suscitan tanta polémica? ¿Son retrógrados los que se oponen a la manipulación con celulas madres embrionarias? ¿Por qué hay tanta ocultación de los logros científicos con células madre adultas? ¿Puede haber criterios científicos asépticos, al márgen de toda consideración ética? ¿Hay algo importante en juego? ¿Qué defienden unos? ¿Qué intentan proteger otros? ¿Por qué se maltratan de tal modo a los embriones humanos cuando el objetivo científico y curativo que se pretende se puede lograr realmente por otros medios más racionales y éticos? Realmente hay algo muy importante en juego: nada menos que el valor de cada vida humana.
#196 Varios Categoria-Varios: Etica y Antropologia
por Natalia López Moratalla, Catedrática de Bioquímica, e Iranzu González de la Tajada, Doctora en Biología y Profesora Ayudante de Histología.
______________________________
I.- Los términos del debate El objetivo biomédico: Usar células madre para curar enfermedades degenerativas
En los últimos años se ha conocido que los tejidos y órganos del cuerpo humano tienen capacidad, con mayor o menor intensidad, de reparar por sí mismos los daños que sufren y regenerarse del desgaste de la edad, o de la enfermedad. Diversas enfermedades, incluidas el Parkinson, alteraciones cardiacas, diabetes, etc., implican una degeneración de células que es irreversible; las células mueren y no son ya reemplazadas de forma natural. Por ello se busca un método que permita producir células humanas de los diferentes tipos que componen nuestro cuerpo, y en perfectas condiciones para transplantarlas o inyectárselas a un paciente, y curarle así los tejidos u órganos que tenga dañados. Esta reparación de tejidos, la medicina reparadora, se basa fundamentalmente en la utilización de células madre.
 Las células madre, son células inmaduras (indiferenciadas o poco especializadas) que se caracterizan porque tienen la posibilidad de madurar (diferenciarse y especializarse) hacia todos, o al menos hacia algunos, de los 200 tipos celulares diferentes que forman nuestro cuerpo, y además por poseer una gran capacidad de multiplicación. En cada estado de la vida de un individuo, ambas propiedades aumentan o disminuyen de manera inversa: para cada célula, diferenciarse es comprometerse en una dirección e ir dejando de multiplicarse, mientras las "jóvenes" células inmaduras crecen en número, dividiéndose y están más indeterminadas: con el paso del tiempo de vida y de acuerdo con el lugar que ocupan en el organismo se van comprometiendo a ejercer funciones concretas, como células de hígado, de la sangre, etc.
Las células madre, son células inmaduras (indiferenciadas o poco especializadas) que se caracterizan porque tienen la posibilidad de madurar (diferenciarse y especializarse) hacia todos, o al menos hacia algunos, de los 200 tipos celulares diferentes que forman nuestro cuerpo, y además por poseer una gran capacidad de multiplicación. En cada estado de la vida de un individuo, ambas propiedades aumentan o disminuyen de manera inversa: para cada célula, diferenciarse es comprometerse en una dirección e ir dejando de multiplicarse, mientras las "jóvenes" células inmaduras crecen en número, dividiéndose y están más indeterminadas: con el paso del tiempo de vida y de acuerdo con el lugar que ocupan en el organismo se van comprometiendo a ejercer funciones concretas, como células de hígado, de la sangre, etc.Aunque quede un largo camino por recorrer, los diversos intentos de obtener las células madre, crecerlas y madurarlas en el laboratorio, indican que en un futuro, más o menos próximo, tal vez de pocos años, será posible una amplia medicina reparadora. Esto no significa, como se ha divulgado a veces, que los científicos estén a punto de fabricar en el laboratorio los órganos necesarios para transplantes, en un momento en que la donación de órganos es ya insuficiente. Significa que se está aprendiendo a copiar y utilizar los sistemas con que de forma natural el organismo repara lesiones, suple perdidas de funcionamiento, o regenera células muertas.
Es posible conseguir las células madre, desde diferentes "fuentes". De una parte, de embriones y fetos destruidos, de embriones producidos in vitro, o de los que se puedan producir por clonación del propio paciente. De otra parte, se tiene la posibilidad de conseguir células madre aislándolas sencillamente de las propias reservas del paciente, o de sangre o de médula ósea, o de grasa, etc. de donantes, sin necesidad de ningún tipo de destrucción. Esta disyuntiva acerca de las fuentes de obtención de células madre es la que está siendo sometida a debate. La disyuntiva de legitimar o no, de apoyar económicamente o no, de legalizar o despenalizar proyectos de investigación que supongan destruir vidas humanas, o incluso producirlas para destruirlas. El valor intrínseco, y no sólo el valor reconocido u otorgado, de cada ser humano es el núcleo del debate.
La "ciencia" no tiene en este debate una única palabra. Hay científicos, creyentes o no creyentes, para quienes como científicos, es imperativo buscar las opciones que no conlleven destrucción. Y hay científicos para quienes un fin bueno justifica cualquier medio; un imperativo de éxito, que insensibiliza para "usar" a unos en beneficio futuro de otros. Mas aún, hay quien piensa que aunque no sea necesario ni imprescindible producir y destruir embriones, para curar enfermedades que afectan a millones de hombres, la puerta de la investigación en ese campo debe dejarse abierta y bien abierta.
Cómo son y dónde se encuentran las células madre
Todas las células que forman los órganos y tejidos proceden de la diferenciación de las que constituyen los tres tejidos embrionarios superpuestos del llamado disco embrionario cuando el embrión alcanza el estado de gástrula:
- el ectodermo (capa externa del disco embrionario)
- el mesodermo (capa intermedia)
- el endodermo (capa interna)
A su vez en el joven embrión en estado de gástrula se encuentran también formadas un grupo de células, células madre germinales, de las que derivaran los gametos.
Estas tres capas del embrión se forman a partir de las células embrionarias pluripotentes, que constituyen la masa interna del embrión en estado de blastocisto. En este estado, el embrión de unos 5 días, está formado por esta masa celular interna, una cavidad acuosa y una capa externa de células, el trofoblasto.
Los dos tipos celulares del blastocisto proceden de las dos primeras células, llamadas blastómeras, diferentes entre sí, en que se divide el cigoto, o embrión unicelular, resultante de la fecundación.
- 1. Nos referiremos en primer lugar a las células madre embrionarias pluripotentes. Son un conjunto de células que forman la masa celular interna de blastocisto, o embrión de 5 días. Aunque sus propiedades y características se conocen desde hace años, hasta 1998 no se habían aislado de embriones humanos. James Thomson y su equipo (1) describieron un método para aislar y mantener en el laboratorio este tipo de células madre embrionarias, procedentes de embriones humanos que “sobraban” en clínicas de fecundación in vitro y que fueron donados para investigación. Estas células embrionarias tienen la capacidad de dar todas las células del cuerpo (son pluripotenciales) y de crecer durante un periodo de dos años, lo que supone aproximadamente entre 300 y 450 divisiones. Sin embargo, es muy difícil controlar su maduración y producen, de hecho, mezclas de diferentes tipos, y sobre todo las que permanecen sin diferenciar se comportan como células tumorales.
Hoy sabemos muy bien que los millares de embriones "sobrantes" congelados son embriones humanos; que las células madre que obtengamos a partir de ellos no son fácilmente controlables; y que cuando sepamos orientarlas para dar neuronas, o células productoras de insulina, etc., habrá que conseguir que no produzcan rechazo por parte del paciente. Demasiadas inseguridades, reales, para las expectativas creadas en miles de enfermos y miles de familias. Y sobre todo, estas células embrionarias pluripotentes, que pudieran diferenciarse in vitro, y que podrían suponer un potencial terapéutico, llevaría siempre consigo la destrucción de embriones humanos.
El debate en este aspecto centra la polémica en dos puntos: acerca de autorizar o no legalmente a emplear estos embriones para investigación con fines terapéuticos, y acerca de otorgar o no fondos públicos para estas investigaciones. Por su parte, algunas empresas multinacionales han preparado y comercializado células pluripotenciales humanas.
- 2. Las células madre germinales del feto se consiguieron en el mismo año. Otro grupo, dirigido por John Gearhart, publicó el cultivo in vitro de células embrionarias germinales, que obtuvieron de fetos abortados de 5 a 9 semanas (2) . Las células madre germinales, pueden madurar y dar lugar a gran variedad de células y crecen durante un máximo de 80 divisiones. Tienen propiedades muy similares a las embrionarias. Estas células madre se han usado ya, tanto en EEUU como en España, para transplantes en enfermos con Parkinson con bastante mal resultado: la mayoría de los pacientes no tuvieron ninguna mejoría y los de más edad sufrieron movimientos incontrolados y tumores cerebrales. La conclusión que se extrae es que los resultados son tan inciertos que todavía se debería limitar este tipo de experimentos al laboratorio y no emplearse en la práctica médica.
- 3. Existen células madre en los órganos y los tejidos del cuerpo de adultos. En 1999, el equipo de Angelo L. Vescovi demostró (3) que las células madre no tienen que proceder necesariamente de embriones para que sean capaces de diferenciarse y dar células especializadas. Mostró la diferenciación en el laboratorio de neuronas de rata a células de la sangre. Las células troncales de adulto están presentes en una gran variedad de tejidos del cuerpo humano, con frecuencia en cantidades pequeñas. Sin embargo, en su mayoría son muy plásticas y pueden madurarse para dar una amplia variedad de tipos celulares. Otras están ya más comprometidas en una dirección, y se denominan células progenitoras. La fuente principal de células madre del cuerpo formado parece ser la médula ósea. Se han encontrado además en la grasa, en la sangre periférica, cerebro, médula espinal, en el interior de los vasos sanguíneos, la piel y tejido conjuntivo, la córnea, la retina, el hígado y el páncreas. El hecho de que las células madre de adulto sean más multipotentes que pluripotentes se convierte en una ventaja terapéutica, ya que es más fácilmente controlable su maduración en la dirección buscada. Al mismo tiempo la ausencia de rechazo inmunológico tras un autotransplante, aporta una gran ventaja para la terapias celulares.
Puede decirse que falta información acerca de la situación real de esta investigación tan prometedora. Las noticias sobre ella carecen del sensacionalismo que conllevan las noticias acerca del uso de las células embrionarias. Y, al mismo tiempo, las empresas farmacéuticas tienen menos posibilidad de lucrar beneficios con estos trabajos. Pero sobre todo, las voces que se alzan a favor del respeto a los embriones se pretenden presentar como un freno del progreso científico. Algunos esgrimen que si un país decide prohibir, o al menos no apoyar decididamente el uso de embriones humanos, quedará rezagado en la investigación biomédica y en la terapia del futuro. En el acaloramiento de este debate, las apuestas de muchos científicos por las células madre de adulto, se silencian por una vía rápida: exigirles "ya" resultados espectaculares; resultados reales del tipo de los prometidos en caso de que se permitiera usar las embrionarias. Realmente, el problema es más de fondo que dilucidar qué células tienen mejores propiedades, como material para futuras acciones terapéuticas.
- 4. Otra importante fuente de células madres de gran plasticidad es la sangre del cordón umbilical. Estas células puede extraerse en el momento del nacimiento sin afectar al neonato ni a la madre y pueden usarse, incluso tras largo tiempo de conservación en frío, para transplantes. No presentan serios problemas de compatibilidad ya que son muy inmaduras y no expresan los marcadores propios del donante. En 1989 el grupo de investigadores de Hal E. Broxmeyer (4) informaron de la curación obtenida de un niño con anemia de Fanconi aprovechando sangre del cordón de una hermana y desde entonces se ha usado con éxito la sangre depositada en los bancos para tratar a personas no emparentadas. Se han creado bancos de almacenamiento de muestras de sangre del cordón umbilical.
Obtención de células madre pluripotenciales embrionarias por clonación
Cientos de experimentos de clonación permitieron el nacimiento, en 1997, de la oveja "Dolly"; se llevó a cabo por transferencia del núcleo de una célula de la ubre a un óvulo de otra oveja a la que se había quitado su propio núcleo. Se demostró así que la información genética del núcleo de una célula diferenciada puede ser artificialmente reprogramada y la célula desdiferenciarse hacia atrás en el tiempo hasta recuperar la información de una célula totipotente inicial capaz de dar origen a un nuevo individuo.
Este logro con la oveja planteó la posibilidad de generar in vitro células madre con potencial terapéutico a partir de un número pequeño de células diferenciadas del paciente a tratar (por ejemplo una muestra de piel o biopsia muscular), sin el problema de rechazo inmune de cualquier transplante que proceda de células de donante. Conocido con el ambiguo nombre de "clonación terapéutica" este tratamiento supone la creación de un hermano clónico del paciente, que se destruiría en una etapa inicial de su desarrollo, la de blastocisto de cinco días, para convertirse en donante de las células de su organismo; por ser un clon del paciente, con igual dotación genética que él, evitaría el problema del rechazo del injerto celular. La clonación con fines terapéuticos se prepara como etapa final y oscura de ese buscado progreso terapéutico.
La revista “The Journal of Regenerative Medicine” publicó el 26 de noviembre de 2001 un artículo, de Cibelli y colaboradores, acerca del “intento fracasado” de obtener embriones humanos clónicos, que la empresa Advance Cell Techonology anunciaba la víspera. El experimento no ha salido ya que no han logrado ni un solo blastocisto, embrión de 5 días que tiene ya formadas las células madre buscadas. Este experimento de intento de clonación ha tenido muchas críticas y rechazo, no sólo porque ha fracasado, sino porque para algunos no es necesario clonar embriones, ya que tenemos los embriones producidos por fecundación in vitro, que sobran. Puestos a producir embriones, bien de “sobra” de la fecundación in vitro, bien clones del paciente, hay que reconocer que estos últimos serían “mejor material biologíco”, por estar preparados “a la carta”.
La historia de la Ciencia enseña que el proceso más parecido a lo natural, mas conservador, el menos invasivo y menos destructivo, ofrece siempre las mejores soluciones y llega a ser el más eficaz y perdurable de los tratamientos. Aún estamos a tiempo de optar. Todavía nos resta por averiguar, tanto en el caso de las células madre de adulto, como en las embrionarias, si las células derivadas de su diferenciación tienen el fenotipo deseado y son capaces de funcionar fisiológicamente de forma correcta: por ejemplo si las células productoras de insulina responden a la glucosa como debe una célula beta del páncreas. Que las células de partida sean las embrionarias de embriones que han de ser destruidos, o sean de las presentes en el mismo enfermo, o se logre estimular y restaurar las funciones neuronales de las células madre presentes en el propio cerebro, etc., depende de la exigencia ética y científica con que hoy día se plantee la investigación. Si los científicos se dejan llevar por las ayudas económicas más fácilmente conseguibles, seremos arrastrados por los intereses económicos de empresas interesadas en comercializar las células madre embrionarias. Si optamos por trabajar seria y mayoritariamente con las células de adulto, el futuro de la terapia celular no llevará la carga moral de destruir vidas humanas.
Decisiones aplazadas: el uso de los embriones congelados
La decisión de usar o no usar para esta investigación las decenas de miles de embriones congelados que parecen existir en nuestro país, es muy delicada. Ciertamente esos embriones tendrán que ser destruidos, dejados morir por descongelación, en algún momento. Ciertamente se ha creado una expectativa de curación de enfermedades. Pero usarlos es abrir una puerta falsa para la medicina, ya que está bien probado que los embriones sobran como consecuencia de una defectuosa práctica médica. Es conocido que, para aumentar la escasa eficacia de las técnicas de fecundación asistida de humanos, se suele inducir una multiovulación; sin embargo la recomendación científica es clara: no activar el ovario, como una etapa más del proceso de fecundación artificial, y por tanto sólo fecundar uno, o a lo sumo dos, óvulos e implantarlos a continuación. Los embriones humanos originados por fecundación de óvulos que proceden de una multiovulación tienen más dificultad para anidar y, los que lo consiguen se desarrollan con más malformaciones que los originados por fecundación del óvulo madurado de forma natural en un ciclo (cfr. 5).
El debate tiene aquí el punto más difícil. Para muchos la ética exige que estos seres humanos de pocos días no “sobren”, de no producir embriones, ni por fecundación in vitro ni por clonación, para investigar ahora y para usarlos más adelante como material terapéutico. Una vida humana debe ser respetada siempre; un ser humano no debería ser jamas un medio, para un fin por bueno que sea ese fin. Más aún, un ser humano no debería nunca de ser producido. Tiene derecho a ser engendrado. Pero para algunos otros, así como para los equipos biomédicos de la clínicas de fecundación asistida, estos embriones realmente sobran: sus padres biológicos no los necesitan ya ("los embriones congelados no tienen proyecto parental", se dice), incluso muchos se han olvidado de ellos. ¿Qué mejor fin para ellos que hacerles útiles para curar a otros en el futuro? ¿No es más ético usarlos que prohibir que sirvan para curar a otros?
Los mismos que en su día, los produjeron "alegremente" en exceso, y siguen haciéndolo, sin prever su futuro, sin tener resuelta otra salida para ellos que permanecer un tiempo en congelación, piden ahora que se legisle como destruirlos y si pueden o no cederlos para investigación. Dejarles morir en paz, sin darles utilidad, se presenta como crueldad. La menos mala de las salidas sería una correcta adopción, lo cual no deja de ser una utopía. Y es que el problema creado no tiene solución: no hay otra salida que optar por impedir que se sigan produciéndose embriones.
Legislación vigente en España
Aunque van surgiendo propuestas declaraciones que podrán cambiar en breve tiempo los convenios, y las leyes, hoy por hoy la situación se resumen en:
La clonación se encuentra prohibida por el Art. 18.2 del Convenio para la protección de los Derechos Humanos y la Dignidad del Ser Humano con respecto a las Aplicaciones de la Biología y la Medicina, suscrito y ratificado por España, vigente en nuestro país desde el 1 de enero de 2000.
En el mismo sentido, el Art. 161 de la Ley Orgánica 10/1995, del Código Penal, castiga a quienes fecunden óvulos humanos con cualquier fin distinto a la procreación humana, así como la creación de seres humanos idénticos por clonación u otros procedimientos dirigidos a la selección de la raza.
La protección del embrión en los procesos de investigación está contemplada en la Ley 35/1988, de Técnicas de Reproducción Humana Asistida, que sólo permite la investigación con embriones viables cuando ésta tenga carácter diagnóstico, terapéutico o preventivo.
Igualmente, el Art. 159.1 de la Ley Orgánica citada, del Código Penal, castiga a los que con finalidad distinta a la eliminación o disminución de taras o enfermedades graves, manipulen genes humanos de manera que se altere el genotipo.
Finalmente, podemos decir que hay una fuerte presión social, de una parte a que le legisle acerca del uso de los embriones sobrantes y, de otra, en cuanto a la fijación de un determinado número de óvulos a extraer o fecundar en los procesos de fecundación in vitro.
Nos implica a todos
Pienso que es clave poder tener la información imparcial y rigurosa que permita a todos analizar con sensibilidad y prudencia y poder tomar parte en este debate que será determinante a la hora de adoptar decisiones legales de tan extraordinario alcance como tenemos planteadas y pendientes. Clarificar, en la medida de lo posible, los términos, técnicas, objetivos etc., de estas investigaciones, desde el punto de vista científico es el primer objetivo de estos “apuntes”.
La cuestión de fondo, no es sólo, si unas células u otras. Si así fuera, no dejaría de ser una "cuestión técnica" a discutir en el seno de la comunidad científica. La alarma social esta creada con justicia. Se acusa a la Iglesia de frenar el progreso médico al exigir, con toda justicia, tanto el derecho a la vida de todo ser humano, como la dignidad de su origen como criatura amada por Dios, creada a su imagen y semejanza.
Esta es la clave última: la tentación a Adán y Eva de "seréis como dioses", si no os dejáis engañar por Dios. El conocimiento científico pone al alcance del hombre "producir" vidas humanas a su antojo, y otorgarles, como si de su creador se tratase, el destino que desee y decida. Antes que el pecado de matar a un hermano por envidia, existió el primero y radical: desconfiar en el amor de Dios por su criatura humana y confiar en la propia sabiduría; decidir sobre lo que es bueno o es malo. Lo expresaba muy lúcidamente las palabras iniciales de un reportaje emitido por la Televisión Española. En él se comparaba la situación nuestra ante esta cuestión actual, con la de nuestros primeros padres en el paraíso ante la decisión de fiarse o no fiarse de la palabra de Dios acerca del bien y del mal. Las palabras que se dijeron, mas o menos literalmente, fueron éstas: "Adán y Eva optaron por la libertad y el progreso". Pensemos.
_____________________________
Bibliografía citada (I)
1. Thomson, J.A., Itskovitz-Eldor, J., Shapiro, .S.S. et al. Embryonic stem cell lines derived from human blastocysts. Science 1998; 282:1145-1147.
2. Shamblott, M.J., Axelman, J., Wang, S. et al. Derivation of pluripotent stem cells from cultured human primordial germ cells. Proc. Natl. Acad. Sci. USA 1998; 95:13726-13731.
3. Bjornson, C.R., Rietze, R.L., Reynolds, B.A., Magli, M.C., Vescovi, A.L. Turning brain into blood: a hematopoietic fate adopted by adult neural stem cells in vivo. Science 1999; 283:534-537.
4. Broxmeyer, H.E., Douglas, G.W., Hangoc, G. et al. Human umbilical cord blood as a potential source of transplantable hematopoietic stem/progenitor cells. Proc. Natl. Acad. Sci. USA 1989; 86:3828-3832.
5. Ertzeid, G., Storeng, R. The impact of ovarian stimulation on implantation and fetal development in mice. Hum. Reprod. 2001; 16:221-225.
II Potencial terapéutico de las células madre humanas
Células madre de adulto en la medicina reparadora
En los últimos años, los avances en la Genética humana, la Biología Molecular y Celular y la Terapia Génica han dado lugar a un cambio considerable en los planteamientos terapéuticos, de forma que los nuevos tratamientos de la Terapia Celular se presentan muy prometedores. A su vez, la aplicación clínica de la técnica de fertilización in vitro en los hombres, y la Biología Celular del Desarrollo han permitido conocer más a fondo los pasos iniciales de la embriogénesis, lo que ha abierto la manipulación de los embriones de mamíferos. Por otra parte, las técnicas de producción de animales transgénicos, impulsó el aislamiento, cultivo y modificación genética de las células del embrión de mamíferos de muy pocos días.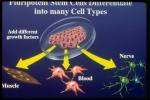 Estas células tienen la posibilidad de madurar y diferenciarse hacia tipos celulares específicos, y poseen una capacidad ilimitada de perpetuarse por multiplicación. Aunque queda un largo camino por recorrer, diversos intentos de transplante o inyección de células preparadas en el laboratorio a ratón, y alguno con humanos, indican ya que es posible una medicina reparadora (Kaji E.H. y Leiden J.M., 2001).
Estas células tienen la posibilidad de madurar y diferenciarse hacia tipos celulares específicos, y poseen una capacidad ilimitada de perpetuarse por multiplicación. Aunque queda un largo camino por recorrer, diversos intentos de transplante o inyección de células preparadas en el laboratorio a ratón, y alguno con humanos, indican ya que es posible una medicina reparadora (Kaji E.H. y Leiden J.M., 2001).
- Algunos descubrimientos han revolucionado recientemente la Biología de las células madre y han mostrado su potencial clínico para paliar diversas enfermedades humanas. En primer lugar se han detectado células madre que mantienen la capacidad de proliferar y madurar hacia diferentes tipos celulares tanto in vitro como in vivo, en órganos, como el cerebro (Johansson C.B., et al., 1999) y el músculo (Gussoni E., et al., 1999), que se pensaba, hasta hace poco tiempo, que carecían de potencial regenerativo. Estudios con animales han sugerido que las células con capacidad de proliferación en el sistema nervioso central desempeñan un papel importante en los procesos de memoria y aprendizaje (Goldman S.A. y Nottebohm F., 1983); y además cultivadas y transplantadas al sistema nervioso central son capaces de diferenciarse a neuronas maduras. Igualmente las células progenitoras inmaduras del músculo esquelético (mioblastos) han podido cultivarse in vitro y después de transplante se han diferenciando y repoblando la zona muscular dañada (Beauchamp J.R., et al., 1999).
- En segundo lugar, se ha comprobado que estas células madre de adulto, especificas de órgano, tienen una gran plasticidad y una vez aisladas se diferencian a una variedad de tipos celulares. Por ejemplo, en experimentos con animales se demostró en 1999 que las células madre neurales se diferencian para dar los linajes de la sangre (Bjornson C.R., et al., 1999), de forma semejante a como lo hacen las procedentes de la médula ósea. A su vez las madre y las progenitoras de la médula de los huesos pasan a otros tipos diferentes de las que constituyen la sangre, incluyendo su maduración a las que forman el músculo esquelético (Ferrari G., et al., 1998), la microglía (Eglitis M.A.,1997) y astroglía (Kopen G.C., et al., 1999) en el cerebro, y a hepatocitos (Petersen B.E. et al. 1999).
Las células madre de adulto son capaces de diferenciarse para dar la variedad de células maduras que se requieren para los tratamientos de transplante celular. La médula de los huesos contiene una gran cantidad de células madre capaces de madurar a diversos tipos celulares. Si bien estas células crecen con más dificultad en el laboratorio que las células madre embrionarias o las fetales, sin embargo permiten que pueda hacerse un autotransplante. De esta forma no hay rechazo y no se necesitaría mantener de por vida al enfermo con tratamiento para evitar el rechazo inmunológico. Las células madre indiferenciadas pueden proceder también de un donante
Terapia celular: transplante de celulas
Los datos comentados sugieren la posibilidad de que las células madre de la medula ósea se puedan llegar a transplantar en tratamientos de enfermedades como distrofia muscular, Parkinson, infarto, o fallo hepático.
Las células madre de adulto están presentes en una gran variedad de tejidos del cuerpo humano, con frecuencia en cantidades pequeñas pues su número disminuye la edad. Sin embargo, en un medio de cultivo adecuado proliferan y se diferencian hasta dar una variedad de tipos celulares de forma más controlada que las células madre embrionarias y fetales. En este sentido el que las células madre de adulto sean más multipotentes que pluripotentes se convierte en una ventaja terapéutica. Al mismo tiempo la ausencia de rechazo inmunológico, al ser propias, aporta una gran ventaja para transplantes celulares.
Reprogramación celular
Se buscan actualmente más alternativas de obtención en mayores cantidades de células madre de adulto. Las firmas Stem Cells Sciences y Biotrasplant consideran que el problema ético de la "clonación terapéutica" podría resolverse utilizando óvulos de animales, especialmente cerdos, filogenéticamente muy cercanos a los seres humanos. En este sentido, ya en 1998, científicos de Advance Cell Techonology, transfirieron material genético humano a óvulos de vacas, consiguiendo un embrión que se dejó vivir solamente unos días; y Stem Cells Sciencies informó el 6 de noviembre de 2000 que habían realizado un experimento similar utilizando óvulos de ratones. Para tratar de justificar éticamente su experimento, la empresa afirmó que los óvulos de ratones no aportaban material genético al híbrido, aunque el 3-4% del material genético del nuevo ser proviene del ADN mitocondrial suministrado por dichos óvulos. Realmente el producto de esa fusión no sería un ser vivo híbrido; no es un cigoto ni humano ni animal. Tal vez cultivada en el laboratorio se pudieran obtener un cultivo de células humanas en cuanto a su dotación genética nuclear y reprogramadas para rejuvenecer hasta células embrionarias. En todo caso, un experimento complejo y de dudosa seguridad de los resultados.
Otro tipo de técnica alternativa a la clonación terapéutica consiste en fusionar una célula somática del paciente con una célula "aceptora" –una célula madre embrionaria, que contiene las señales adecuadas–, de forma que se desarrolle directamente al tipo celular que necesita el paciente. El precedente es una investigación, dirigida por Azim Surani (Tada M., et al., 1997) y llevada a cabo por investigadores de la "Wellcome/CRC Institute of Cancer Research and Developmental Biology" en Cambridge. Fabricaron una célula híbrida de ratón entre una célula del timo y una célula madre embrionaria germinal (precursora de los gametos) que fue capaz de diferenciarse a una amplia variedad de tipos celulares de forma semejante a una típica célula madre embrionaria. Se pretende de este modo desdiferenciar células somáticas adultas hasta células madre embrionarias; posteriormente se cultivarían para obtener células del tejido original, o de otro tejido. En el Congreso de la Sociedad Británica de Fertilidad, celebrado el 23 de febrero de 2001, investigadores de la firma comercial PPL Therapeutics, en la que participa también el Instituto Roslin, informaron que habían logrado transformar células adultas de piel de vaca en células madre multipotentes, y habían obtenido de ellas células de músculo cardiaco.
Terapia génica combinada con la Terapia celular
Las alteraciones genéticas hereditarias, que están en la base de algunas enfermedades, estarían también presentes en las células madre por lo que en tales casos habría que recurrir a una terapia celular y genética combinada (Watt F.H. y Hogan B.L., 2000).
La identificación de genes implicados en enfermedades humanas, y el desarrollo de nuevos vectores capaces de dirigir los genes deseados a diferentes tejidos in vivo, han dado lugar a nuevos y significativos progresos en el área conocida como Terapia Génica. Con este tratamiento se trata de modificar algunos genes en el interior de las células y producir así el efecto terapéutico deseado. Las modificaciones genéticas pueden llevarse a cabo en cultivo, y las células manipuladas se administran después al paciente. También pueden modificarse las células in vivo (Mulligan R.C., 1993; Fuchs E., y Segre J.A., 2000).
La mayor parte de los estudios que se han realizado hasta la fecha pretenden reemplazar un gen defectuoso por una copia normal; es éste el caso de enfermedades causadas por la alteración de un sólo gen; así ocurre con el gen regulador transmembrana en el epitelio respiratorio de enfermos con fibrosis quística (Knowles M.R., et al., 1995), o el gen del receptor de LDL en el hígado de pacientes con hipercolesterolemia familiar (Grossman M., et al., 1994).
También se usan estos procedimientos en terapias antitumorales en que se introducen genes capaces de producir una reacción citotóxica, como el de la timidina quinasa del virus herpes simple (Vile R.G., et al., 2000) o genes angiogénicos, como el factor de crecimiento vascular endotelial, en el tratamiento del infarto de miocardio (Losordo D.W., et al., 1998).
Actualmente, se investigan las bases genéticas de enfermedades complejas, multigénicas, como la diabetes mellitus o la enfermedad de Alzheimer, con el fin de corregir y reemplazar las células nerviosas, o las células beta del páncreas destruidas.
Una combinación de las Terapias Génica y Celular puede ser útil para el tratamiento de algunas enfermedades. Por ejemplo, el implante de células madre de músculo esquelético, previamente modificadas genéticamente para que expresen y secreten proteínas, como la eritropoyetina o la hormona de crecimiento, permitiría un aporte estable de proteínas con capacidad terapéutica al torrente circulatorio; de igual forma células del miocardio, o del hígado, a las que se les inserta una copia del gen que tienen defectuoso pueden ser útiles en el tratamiento de pacientes con mutaciones heredadas en un gen, como la hemofilia o la distrofia muscular (Barr E. y Leiden J.M., 1991; Ye X. , et al., 1999; Bohl D., et al., 1997 ). Durante años se han intentado introducir copias normales del gen de la distrofina para producir la proteína normal en el músculo de pacientes con distrofia muscular de Duchenne (Morgan J.E., 1994). También en el laboratorio de Kunkel se inyectaron mioblastos sanos procedentes de un familiar, pero el gen que codifica esta proteína se dejó de expresar al cabo de seis meses (Gussoni E., et al., 1997). Más recientemente este equipo ha publicado el resultado positivo de tratar ratones con este tipo de enfermedad con células madre de la médula ósea y musculares (Gussoni E., et al., 1999).
Se podría evitar, corrigiendo las células, la proliferación de las sanguíneas en leucemias. Las células madre de la médula ósea son muy aptas para la transferencia de genes: gracias a su capacidad de hematopoyésis aportarían un suministro de células sanguíneas modificadas genéticamente. Se ha descrito una proteína intracelular que estimula el crecimiento de células madre de adulto y se plantea su uso en tratamiento de tumores en que los enfermos han sufrido quimioterapia o radiación y reemplazar así su sistema inmunitario (Bhardwaj G., et al., 2001).
Otra posibilidad de terapia combinada se basa en la capacidad de las células madre de emigrar a sitios específicos. Esto permite utilizarlas también para transportar fármacos hasta diversos tejidos patológicos, o lesionados, según se comprueba en las interesantes investigaciones de Karen Aboody (Aboody K., et al., 2000) en las que inserta en células madre un gen capaz de reducir diversos tipos de tumores. Inyectando estas células madre portadoras del gen en distintos lugares del cerebro de ratas, demuestra que las células madre inyectadas emigran hacia el tumor, lo rodean y eliminan un gran número de sus células patológicas, disminuyendo así el tamaño del tumor.
Las células madre son capaces de emigrar y de diferenciarse a células del tejido correspondiente. Por ello la Terapia Celular podrá llevarse además de por inclusión en el propio tejido lesionado de fracciones "sanas" de ese mismo tejido, por inclusión en el tejido dañado, o en el torrente circulatorio del paciente, de células madre de ese mismo o de otro tejido.
Con estos tratamientos se han obtenido ya resultados clínicos patentes y manifiestos en áreas como los trasplantes de médula ósea o el tratamiento de quemados con queratinocitos cultivados en el laboratorio. Es, por tanto, esperable que las estrategias derivadas de la utilización de células de adulto alcancen los objetivos que la investigación básica y clínica tiene planteados. Y es muy deseable también que los científicos sean capaces de rechazar las amplísimas ofertas financieras para producir y usar embriones humanos, o clonar al paciente, y de emplearse de lleno en las potentes reservas de células madre pluripotentes o multipotentes del organismo.
Ingeniería tisular
La conversión en cultivo de células madre obtenidas de tejido adulto hacia células de diferentes tejidos, conduce en general a una masa amorfa del nuevo tejido o a su inserción en el tejido al que se transplantan. No parece aún asequible la formación de órganos completos a partir de estas células madre (McCarty M., et al., 2000); tendrían para ello que crecer sobre un esqueleto de fibras sobre el que las células que se van generando puedan ordenarse; así se está intentando la creación de tejido cardiaco humano.
En noviembre de 2001 la revista Nature publicó un interesante trabajo de Bianco y Bobey acerca de lo que se ha denominado “ingenieria de tejidos”, a partir de células madre de adulto. La capacidad regenerativa de las células madre puede encauzarse hacia la restauración a largo plazo de la piel, o el hueso, por ejemplo.
Fuentes de células madre humanas de adulto
El año 1999 se ha considerado el año de reinado de las células troncales y se afirma que las células pluripotenciales adultas han "destronado" a las embrionarias en lo que se refiere a las posibilidad de su uso con fines terapéuticos (Keller G. y Snodgrass H.R., 1999; Pedersen R.A., 1999; Weissman I.L., 2000). El debate suscitado por la destrucción de embriones de los que se obtienen las células pluripotentes ha potenciado la orientación de muchos otros trabajos hacia células madre de organismos adultos.
Los primeros frutos se recogieron a principios del año 1999, cuando un grupo de científicos italianos y canadienses (Bjornson, C.R. et al., 1999), al que nos hemos referido ya, demostraron que las células madre neuronales de organismos adultos son capaces de diferenciarse a células del sistema hematopoyético. Este hallazgo confirma que las señales del entorno donde se sitúan las células troncales condicionan su función futura y por ello una célula madre adulta puede abandonar su función originaria y adoptar una nueva capacidad. Por otra parte, existe también la posibilidad de transformar, desdiferenciándolas, células somáticas de adulto hasta células madre, que posteriormente pueden cultivarse para obtener células de su propio tejido o de otro. Sin embargo, las experiencias en este punto, son aún escasas.
Células madre del tejido adiposo
Hedrick y sus colegas decidieron buscar estas células en la grasa porque al igual que las troncales de la médula ósea se desarrollan a partir de la misma capa de tejido embrionario, el mesodermo, y los tejidos que tienen el mismo origen tienen propiedades comunes. Han encontrado, y aislado, abundantes células en el material que se elimina en los tratamientos de liposucción, con capacidad de diferenciarse hacia otras especializadas comparable a las embrionarias: hueso, condrocitos (células de cartílago), músculo y adipocitos maduros (Zuk P. A., et al., 2001). Para diferenciarlas a hueso las cultivaron en un medio que contiene calcio, fosfato y vitamina C. Y variando los nutrientes han sido capaces de obtener cartílago, músculo, o más células grasas. Sin duda estos trabajos puede ser un paso importante y posiblemente el primer paso para la solución de lesiones de cartílagos de pacientes utilizando su propia grasa.
Células madre del cerebro
Muchas de las enfermedades del sistema nervioso resultan de una perdida de células neurales y las células maduras no se dividen para reemplazar las alteradas. Por ejemplo, en la enfermedad de Parkinson mueren las neuronas que producen dopamina, en la de Alzheimer las responsables de la producción de ciertos neurotransmisores; en la esclerosis lateral amiotrófica mueren las neuronas motoras que activan los músculos y en la esclerosis múltiple se pierden las células de la glía que protegen las fibras nerviosas. En las lesiones de la médula espinal, en el trauma cerebral e incluso en un infarto cerebral, mueren otros tipos de neuronas.
La posibilidad de crear tejido nervioso nuevo a partir de células madre, restaurando así las funciones neurales, supone una esperanza de tratamiento de estas enfermedades. En el cerebro de adultos se encuentran células troncales (McKay R.D.G., 1997; Svendsen C.N., et. al., 1998), localizadas en los ventrículos laterales y en núcleo dentado del hipocampo, capaces de dividirse y de dar origen a neuronas (Doetsch F., et al., 1999).
Estas células troncales neuronales responden a factores, denominados neurotropinas (Johe K. et al. 1996). Jeffrey Kocsis, de la Universidad de Yale, comprobó que en muchas ocasiones las lesiones de la médula espinal no cortan completamente a las fibras nerviosas que discurren a lo largo de toda ella, por lo que, en teoría, podrían repararse, ya que las células madre pueden migrar a lo largo de la médula espinal (Janoskuti L. et al., 2000).
Otros de los beneficiarios del tratamiento con células troncales pueden ser los pacientes que han sufrido un accidente cerebrovascular. Las células pluripotentes cerebrales se pueden regenerar, ya que están presentes en el cerebro a lo largo de toda la vida. De esta forma, la isquemia en sí misma estimula las nuevas neuronas, lo que puede ser una respuesta protectora que facilita la función de la memoria. También las células madre pueden migrar hacia regiones cerebrales puntualmente dañadas. Barbara Tate (Mitchell J.K., et al., 2001) ha comprobado en ratas con Alzheimer experimental que las células madre inyectadas se desplazan hasta la parte del cerebro lesionada, depositándose sobre la placa de Alzheimer, al igual que en los experimentos con animales; estos datos sugieren que estas células madre neurales podrán ser útiles para reparar lesiones cerebrales como la esclerosis múltiple que entrañan disfunciones globales del cerebro y no sólo enfermedades como el Parkinson debidas a alteraciones localizadas.
La cantidad y la localización cerebral de estas células madre suponen una limitación para su uso terapéutico; sin embargo existen otras fuentes de células madre humanas, como la médula ósea, y que son capaces de reprogramarse en el laboratorio para dar células nerviosas inmaduras. También las células troncales, obtenidas de cerebros de personas muertas y cultivadas in vitro (Palmer T.D. et al., 2001), son una nueva fuente potencial para el tratamiento del Parkinson y otras enfermedades neurodegenerativas.
Las células madre neurales presentan un gran potencial en tratamientos antitumorales como vehículo capaz de alcanzar el cerebro de genes adecuados. Así, transfectadas con el gen que codifica la IL-4 se han transferido a ratones con gliomas (Benedetti S., et al., 2000).
Otros trabajos se han dirigido a restaurar el cerebro, haciendo proliferar y diferenciarse in situ las células madre neurales. La simple adición de un factor de crecimiento las estimula (Kondo T. y Raff M., 2000; Tuszynski, 2000); y de esta forma los investigadores esperan aportar los componentes colinérgicos de las neuronas perdidas en los enfermos de Alzheimer. Otro trabajo (Fallon J. et al., 2000) muestra que la infusión del factor denominado factor de crecimiento transformante (alfa-TGF) a ratas con la enfermedad similar a Parkinson induce una proliferación rápida de células madre neurales, seguida de su migración y diferenciación a neuronas; las ratas tratadas muestran un descenso de los síntomas. Se está tratando además de conseguir un incremento de la supervivencia de las células transplantadas inhibiendo el proceso de muerte programada (Schierle, G.S. et al., 1999).
Estos datos predicen una estrategia alternativa a los transplantes celulares como metodología para tratar las enfermedades neurodegenerativas. Se ha descrito además que los oligodendrocitos pueden ser reprogramados, dando lugar a células madre neurales adultas progenitoras que generan los múltiples tipos celulares del cerebro (Kondo T. y Raff. M., 2000).
Células madre neurales del bulbo olfatorio
En 1992, Reynolds y Weiss describieron la presencia de una zona de células madre neurales durante el desarrollo del cerebro de roedores; es una zona de intensa proliferación y la progenie de células madre en parte muere y otra parte da lugar a progenitores neuronales que migran hacia el bulbo olfatorio. Se han identificado y aislado células madre en ratón, que se han diferenciado a neuronas y propagado en cultivos durante varios meses. También se han aislado células madre derivadas del bulbo olfatorio de hombre adulto que han crecido y establecido una línea celular troncal neural (Giombimid S., et al., 2000).
Estas células se diferencian para dar los tres tipos clásicos de células nerviosas (neuronas, astrocitos y oligodendrocitos), en respuesta a factores de crecimiento. El descubrimiento de una intensa regeneración potencial del bulbo olfatorio y la posibilidad de expandir células madre neurales autólogas ofrecen una fuente excelente de células para transplante en terapias dirigidas a varias enfermedades neurodegenerativas, mediante una simple bulbotomía parcial: Alzheimer, esclerosis multiple, Parkinson, lesiones cerebrales.
Estas células madre podrían obtenerse también de personas muertas (Roisen F. et al., 2001; Liu N. et al., 1998) y posteriormente inducir su expansión y diferenciación in vitro para aportar neuronas, transplantables a pacientes.
Células troncales en el ojo: cornea y retina
En los años 1980 se encontraron células troncales en la cornea, en el área llamada limbus, en la intersección entre la superficie externa del ojo, la cornea y la superficie del globo ocular al interior. El transplante de células madre limbales permite que una pequeña muestra del ojo del paciente en buen estado, o de un donante no relacionado con él, puede restaurar la visión perdida por agentes químicos o enfermedades (Chuck R. et al., 2001). Como muestran los trabajos de Chuck este transplante de células madre a la cornea ha corregido en muchos pacientes la enfermedad conocida como síndrome de Stevens-Johnson, que cursa con ceguera. Pacientes con problemas de retina necesitarán transplantes de células troncales y/o activación de sus propias células con factores de crecimiento. En ratas se han aislado ya células madre de la retina (Ahmad I., et al., 1998) lo que representa un signo positivo de las posibilidades de regeneración retinal.
Células madre en el folículo del pelo y de la pie
Las células madre epiteliales son células progenitoras primitivas que permiten el continuo recambio de la piel humana a lo largo de la vida. El 90% de la piel está cubierta de pelo. En el folículo del pelo existen células madre (Sun T.T., y Lavker R., 2001), que podrán ser excelentes dianas para terapias génicas en enfermedades de la piel como la alopecia. Y la terapia génica que modifique estas células podría tener un papel en tratamientos antitumorales y también para combatir enfermedades como la psoriasis.
Células troncales en el páncreas de animales
La diabetes juvenil (tipo 1) es una enfermedad autoinmune caracterizada por la destrucción de las células del páncreas productoras de insulina. Se han hecho esfuerzos por lograr transplantes de islotes pancreáticos beta para restaurar la producción y secreción de la hormona, pero están limitados tanto por el número de donantes como por la toxicidad de los tratamientos inmunosupresores requeridos para evitar el rechazo. Se han descubierto células madre que pueden generar células productoras de insulina. Las precursoras de los islotes existen solamente en los conductos pancreáticos y cuando se exponen al estimulo de factores de crecimiento, pueden diferenciarse en nuevas células de islotes que pueden migrar (Zulewski H. et al., 2001).
Células musculares inmaduras
Un especial interés tiene la obtención de células musculares. El equipo de Vescovi en el año 2000, ha demostrado que el aislamiento y clonación de células madre nerviosas derivadas de ratones y humanos podría producir celulas musculares inmaduras in vitro e in vivo y que después los miocitos pueden trasplantarse en animales adultos. Precisamente se ha demostrado que las células madre de adulto y no justamente las embrionarias pueden diferenciarse a células de músculo cardiaco incluso en venas en ratón (Orlic D., et al., 2000). Cuando los mioblastos esqueléticos se inyectan en músculo cardiaco de un animal que ha sufrido un ataque cardiaco las células madres significativamente inducen la función cardiaca y la capacidad de ejercicio.
Las células troncales (especialmente las de la médula ósea) podrían ser utilizadas para prevenir o incluso reparar alteraciones del corazón en personas que han sufrido un ataque o un infarto de miocardio; la inyección de células troncales de este origen les permite llegar al corazón y vasos del animal con lesiones de corazón y revierten estas alteraciones. En el trabajo citado se ha comprobado que las señales para esa diferenciación están presentes en los músculos adultos, lo que sugiere que los tejidos adultos contienen la información necesaria para instruir a las células trasplantadas a que adopten las características apropiadas para la nueva localización.
Se ha conseguido que células de músculo inmaduras, trasplantadas a un tejido muscular dañado, se transforman en células musculares adultas sanas fusionándose con las originales dañadas y regenerándolas (Beauchamp J.R. et al., 1999).
Se ha realizado ya (Menasche P., et al., 2001) la primera experiencia clínica de trasplante autólogo de mioblastos en un paciente de 72 años con isquémia cardiaca por una coronariopatía. Los mioblastos se cultivaron en el laboratorio durante 2 semanas y al mes de trasplantarlos se comprobó que la situación clínica había mejorado seguramente por reposición a partir de los mioblastos trasplantados de las células cardiacas dañadas.
______
Bibliografía (II)
Aboody, K.S., Brown, A., Rainov, N.G. et al. From the cover: neural stem cells display extensive tropism for pathology in adult brain: evidence from intracranial gliomas. Proc. Natl. Acad. Sci USA. 2000; 97:12846-12851.
Ahmad, I., Acharya, H.R., Rogers, J.A., et al. The role of NeuroD as a differentiation factor in the mammalian retina. J. Mol. Neurosci. 1998; 11:165-178.
Barr, E., Leiden, J.M. Systemic delivery of recombinant proteins by genetically modified myoblasts. Science 1991; 254:1507-1509.
Beauchamp, J.R., Morgan, J.E., Pagel, C.N., Partridge, T.A. Dynamics of myoblast transplantation reveal a discrete minority of precursors with stem cell-like properties as the myogenic source. J. Cell Biol. 1999; 144:1113-1122.
Benedetti, S., Pirola, B., Pollo, B., et al. Gene therapy of experimental brain tumors using neural progenitor cells. Nat. Med. 2000; 6:447-450.
Bhardwaj, G. et al. Sonic hedgehog induces the proliferation of primitive human hematopoietic cells via BMP regulation. Nature Immunology 2001; 2:172-180.
Bjornson, C.R., Rietze, R.L., Reynolds, B.A., Magli, M.C., Vescovi, A.L. Turning brain into blood: a hematopoietic fate adopted by adult neural stem cells in vivo. Science 1999; 283:534-537.
Bohl, D., Naffakh, N., Heard, J.M. Long-term control of erythropoietin secretion by doxycycline in mice transplanted with engineered primary myoblasts. Nat. Med. 1997; 3: 299-305.
Brustle, O., McKay, R.D. Neuronal progenitors as tools for cell replacement in the nervous system. Curr. Opin. Neurobiol. 1996; 6:688-695.
Chuck, R., Behrens, A., McDonnell, P.J. Microkeratome-based limbal harvester for limbal stem cell transplantation: preliminary studies. Am. J. Ophthalmol. 2001; 131:377-378.
Clarke, D.L., Johansson, C.B., Wilbertz, J., et al. Generalized potential of adult neural stem cells. Science 2000; 288:1660-1663.
Doetsch, F., Caille, I., Lim, D.A., Garcia-Verdugo, J.M., Alvarez-Buylla, A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell 1999; 97:703-716.
Eglitis, M.A., Mezey, E. Hematopoietic cells differentiate into both microglia and macroglia in the brains of adult mice. Proc. Natl. Acad. Sci. USA 1997; 94:4080-4085.
Fallon, J. et al. In vivo induction of massive proliferation, directed migration, and differentiation of neural cells in the adult mammalian brain. Proc. Natl. Acad. Sci. USA 2000; 97:14686-14691.
Ferrari, G., Cusella-De Angelis, G., Coletta, M. et al. Muscle regeneration by bone marrow-derived myogenic progenitors. Science 1998; 279:1528-1530.
Fuchs, E., Segre, J.A. Stem cells: a new lease on life. Cell 2000; 100:143-155.
Giombinid, S., Soleroe, C.L., Paratia, E.A. Isolation and characterization of neural stem cells from the adult human olfactory bulb. Stem Cells 2000; 18:295-300.
Goldman, S.A., Nottebohm, F. Neuronal production, migration, and differentiation in a vocal control nucleus of the adult female canary brain. Proc. Natl. Acad. Sci. USA 1983; 80:2390-2394.
Grossman, M., Raper, S.E., Kozarsky, K. et al. Successful ex vivo gene therapy directed to liver in a patient with familial hypercholesterolaemia. Nat. Genet. 1994; 6:335-341.
Gussoni, E., Blau, H.M., Kundel, L.M. The fate of individual myoblasts after transplantation into muscles od DMD patients. Nat. Med. 1997; 3:970-977.
Gussoni, E., Soneoka, Y., Strickland, C.D. et al. Dystrophin expression in the mdx mouse restored by stem cell transplantation. Nature 1999; 401:390-394.
Jacobson, L.O., Marks, E.K., Robson, M.J. et al. Effect of spleen protection on mortality following x-irradiation. J. Lab. Clin. Med. 1949; 34:1538-1543.
Janoskuti, L., Kocsis, J., Lengyel, M. Osteogenesis imperfecta membranosus kamrai septumdefektussal. [Ventricular septal defect in osteogenesis imperfecta]. Orv. Hetil. 2000; 141:1413-1414.
Johansson, C.B., Momma, S., Clarke, D.L., et al. Identification of a neural stem cell in the adult mammalian central nervous system. Cell 1999; 96:25-34.
Johe, K., Hazel, T.G., Muller,T. et al. Single factors direct the differentiation of stem cells from the fetal and adult central nervous system. Genes and Development 1996; 10:3129-3140.
Kaji, E.H., Leiden, J.M. Gene and stem cell therapies. JAMA 2001; 285:545-550.
Keller, G., Snodgrass, H.R. Human embryonic stem cells: the future is now. Nature Medicine 1999; 5:151-152.
Knowles, M.R., Hohneker, K.W., Zhou, Z. et al. A controlled study of adenoviral-vector-mediated gene transfer in the nasal epithelium of patients with cystic fibrosis. N. Engl. J. Med.1995; 333:823-831.
Kocher, A.A., Schuster, M.D., Szabolcs, M.J. et al. Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function. Nat. Med. 2001; 7:430-436.
Kondo, T., Raff, M. Oligodendrocyte precursor cells reprogrammed to become multipotent CNS stem cells. Science 2000; 289:1754-1757.
Liu, N.; Shields, C.B.; Roisen, F.J. Primary culture of adult mouse olfactory receptor neurons. Exp. Neurol. 1998; 151:173-183.
Losordo, D.W., Vale, P.R., Symes, J.F. et al. Gene therapy for myocardial angiogenesis: initial clinical results with direct myocardial injection of phVEGF165 as sole therapy for myocardial ischemia. Circulation 1998; 98:2800-2804.
McCarthy, M. Bioengineers bring new slant to stem-cell research. Lancet 2000; 356:1500.
McKay, R.D.G. Stem cells in the central nervous system. Science 1997; 276:66-71.
Menasche, P., Hagege, A.A., Scorsin, M. et al. Myoblast transplantation for heart failure. Lancet 2001; 357:279-280.
Mitchell, K.J., Pinson, K.I., Kelly, O.G. et al. Functional analysis of secreted and transmembrane proteins critical to mouse development. Nat. Genet. 2001; 28:241-249.
Morgan, J.E. Cell and gene therapy in Duchenne muscular dystrophy. Hum. Gene Ther. 1994; 5:165-171.
Morrison, S.J., White, P.M., Zock, C., Anderson, D.J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell 1999; 96:737-749.
Mulligan, R.C. The basic science of gene therapy. Science 1993; 260:926-932.
Orlic, D., Kajstura, J., Chimenti, S., et al. Bone marrow cells regenerate infarcted myocardium. Nature 2001; 410:701-705.
Orlic, D., Kajstura, J., Chimenti, S., et al. Bone marrow cells regenerate infarcted myocardium. Nature 2001; 410:701-705.
Palmer, T.D., Schwartz, P.H., Taupin, P. et al. Cell culture. Progenitor cells from human brain after death. Nature 2001; 411:42-43.
Petersen, B.E., Bowen, W.C., Patrene, K.D. et al. Bone marrow as a potential source of hepatic oval cells. Science 1999; 284:1168-1170.
Pedersen, R.A. Células madre embrionarias en Medicina. Investigación y Ciencia. 1999; Junio: 64-69.
Roisen, F.J., Klueber, K.M., Lu, C.L. et al. Adult human olfactory stem cells. Brain. Res. 2001; 890:11-22.
Sandmaier, B.M., Storb, R., Kinley, J. et al. Evidence of allogeneic stromal engraftment in the bone marrow using canine mesenchymal stem cells. Blood 1998;92:116.
Schierle, G.S., Hansson, O., Leist, M. et al. Caspase inhibition reduces apoptosis and increases survival of nigral transplants. Nature Med. 1999; 5:97-100.
Svendsen, C.N., terBorg, M.G., Armstrong, R.J.E. et al. A new method for the rapid and long term growth of human neural precursor cells. J. Neurosci. Meth. 1998; 85:141-153.
Tada, M., Tada, T., Lefebvre, L. et al. Embryonic germ cells induce epigenetic reprogramming of somatic nucleus in hybrid cells. EMBO J. 1997; 16:6510-6520.
Tuszynski, M.H. Intraparenchymal NGF infusions rescue degenerating cholinergic neurons. Cell Transplant 2000; 9:629-636.
Vile, R.G., Russell, S.J., Lemoine, N.R. Cancer gene therapy: hard lessons and new courses.Gene Ther. 2000; 7:2-8.
Watt, F.M., Hogan, B.L. Out of Eden: Stem cells and their niches. Science 2000; 287:1427-1430.
Weissman, I.L. Translating stem and progenitor cell biology to the clinic: barriers and opportunities. Science 2000; 287:1442-1446.
Ye, X., Rivera, V.M., Zoltick, P. et al. Regulated delivery of therapeutic proteins after in vivo somatic cell gene transfer. Science 1999; 283:88-91.
Zuk, P.A., Zhu M., Mizuno, H. et al. Multilineage Cells from Human Adipose Tissue: Implications for Cell-Based Therapies. Tissue Eng. 2001; 7:211-228.
Zuleswski, H., Abraham, E.J., Gerlach, M.J. et al. Multipotential nestin-positive stem cells isolated from adult pancreatic islets differentiate ex vivo into pancreatic endocrine, exocrine, and hepatic phenotypes. Diabetes 2001; 50:521-33.
III Células madre de la médula ósea. La sangre del cordón umbilical
Células madre progenitoras de las células de la sangre
Las células madre de la sangre humana se han usado desde hace más de 40 años con fines terapéuticos. En efecto, el trasplante realizado con células madre de médula ósea del propio paciente, o de médula ósea, sangre periférica, o cordón umbilical, de un donador sano y compatible inmunológicamente con el paciente, se ha utilizado en enfermedades inmunológicas, fallos de la médula ósea y diversas enfermedades hematológicas, incluidas las talasemias.
Hacia los años 50, dos grupos de investigadores (Jacobson L.O., et al.,1949; Lorenz E., et al.,1951) indicaron la posibilidad de inyectar por vía intravenosa las células de la medula ósea para restaurar las células sanguíneas destruidas en animales letalmente irradiados. Mas tarde, otros investigadores (Till J.E. y McCulloch E.A., 1961) señalaron que era posible tal reconstrucción con las células madre hematopoyéticas. Cada colonia deriva de un único precursor que da origen a todos los linajes hematopoyéticos y tiene además capacidad de autorenovación. Inicialmente, las células madre hematopoyéticas se caracterizaron por la expresión de algunos de los antígenos marcadores de membrana, como el CD34. Recientemente se ha descrito un nuevo tipo de células madre, similares a fibroblastos primarios, y carentes de CD34, presentes en la médula ósea, la sangre periférica y la del cordón umbilical, y que constituyen el componente predominante de la población en reposo de las células madre hematopoyéticas y del mesénquima (Huss R. 2000), de las que hablaremos después.
Células troncales de la sangre del cordón umbilical
Una de las fuentes más prometedoras de células pluripotenciales es la sangre del cordón umbilical que puede extraerse en el momento del nacimiento sin afectar al neonato ni a la madre; 4 millones de células precursoras pueden obtenerse a partir de 200 ml de sangre del cordón (Harris D.T. et al. 1994) que pueden usarse, incluso tras largo tiempo de crioconservación, en transplantes (Broxmeyer H.E., et al., 1994; Gluckman E., et al., 1989), y posiblemente en terapia génica.
Estas células ya se han aislado y purificado (Storms R.W., et al., 1999). La sangre del cordón presenta menos problemas de compatibilidad ya que las células madre presentes en ella difieren de las de la médula ósea y son más tolerantes (Kline R.M., 2001). No sólo generan hematíes normales y leucocitos (por lo que se pueden usar para ayudar a renovar los hematíes en personas con anemia falciforme y para restablecer el sistema inmunitario de niños nacidos con una inmunodeficiencia grave), sino también otras células cerebrales de sostén como la microglía, por lo que se usan para aportar enzimas que estén alterados hereditariamente en enfermedades, como el síndrome de Hurler, en el que tal alteración enzimática conduce a una degeneración neurológica. Ante las ventajas evidentes de los transplantes de sangre del cordón umbilical numerosos hospitales e institutos clínicos han establecido bancos donde la madre pueda depositar la sangre del cordón umbilical del hijo.
En 1989 el grupo de investigadores de Hal E. Broxmeyer demostraron que esta sangre tenía tantas células madre como la medula ósea; ese mismo año el primero de ellos con Eliane Gluckman informaron de la curación obtenida de un niño con anemia de Fanconi aprovechando sangre del cordón de una hermana (Gluckman, E., et al.,1989). Desde entonces se ha usado la sangre depositada en los bancos para tratar a personas no emparentadas (citado en Kline R.M., 2001; cfr. la revisión Mayani H. y Lannsdorp P.M., 1998). Recientemente se ha descrito que estas células pueden reparar lesiones cerebrales (Zigova T., et al., 2001).
Células madre mesenquimales
Las células progenitoras CD34– han podido aislarse de la medula ósea y de la sangre periférica y datos preliminares muestran que pueden obtenerse de forma muy eficiente de la sangre del cordón umbilical (Huss R., et al., 1997). Está claro que las células madre de las que derivan las de la sangre (hematopoyéticas) CD34– en reposo junto a otras con morfología similar a fibroblastos, sirven de rodeamiento celular, proveen de los factores de crecimiento necesarios y permiten el contacto célula a célula equilibrando el delicado balance de la diferenciación y proliferación de la progenie hematopoyética (Huss R. 1998).
Hay datos crecientes de que las células madre del mesénquima reconstituyen la médula ósea y liberan las células progenitoras a la circulación (Sandmaier B.M., et al., 1998); así las células madre del mesénquima son precursoras de otras células del mesénquima en órganos (Pittinger M.F., et al.,1999).
Un primer ensayo clínico se ha efectuado usando las células madre del mesénquima derivadas de la médula ósea para el tratamiento de niños con una formación de huesos imperfecta (Horwitz E.M., et al., 1999). Las células CD34– mesenquimales son también capaces de generar las específicas de otros tejidos (Makino S., et al. 1999). Se ha sugerido su potencial neoangiogenico (Ziegler B.L. et al., 1999) y para un amplio espectro de tratamientos de Terapia Génica (Reiser J., et al., 1996; Bianco P., 2001). Las células madre del estroma de la médula ósea están implicadas en la formación del hueso (Ascenzi A. 1976) y pueden ser usadas en la reconstrucción de miembros (Kadiyala S., et al., 1997; Bruder S.P., et al.,1998; Gazit D., et al.,1999; Krebsbach P.H., et al., 1998).
Células madre de la médula ósea
La médula ósea no sólo retiene a lo largo de la vida la capacidad de regenerar las células troncales progenitoras sino que da lugar a las células de la sangre, de hueso y de cartílago. Como ya se comentó, los primeros experimentos de diferenciación de células troncales de la médula ósea se realizaron, cuando el equipo de Eglitis, y el de Kopen, consiguieron obtener células nerviosas. También se han obtenido, a partir células de la médula ósea, células musculares (Ferrari G. et al., 1998), hepáticas (Petersen B.E. et al.,1999), y de endotelio vascular (Gao Z., 2001). Los neurocientíficos continúan buscando alternativas a las neuronas (Brazelton T.R., et al., 2000) procedentes de células madre embrionarias o inmaduras fetales como fuente alternativa para la regeneración de zonas dañadas del cerebro. Las células madre de la médula ósea son realmente accesibles y pueden obtenerse del propio enfermo, sin problema de rechazo.
Tradicionalmente el transplante de células madre de la médula ósea (CD34+) se realizó por infusión de una mezcla de las diferentes células (Thomas E.D., et al.,1975; Deeg H.J., et al., 1988). Un avance fue seleccionar y eliminar, mediante anticuerpos monoclonales, células no deseadas, como los linfocitos B para transplantes autológos a pacientes con linfomas no-Hodgkin o mieloma múltiple (Anderson K.C., et al., 1991). Otra fuente de células troncales es la sangre periférica y la del cordón umbilical desde donde pueden obtenerse (Bender J.G., et al., 1994), creciéndolas in vitro antes de reinyectarlas al paciente sometido a radio o quimioterapias intensivas (Campos L., et al., 1993; Siena S., et al. 1989).
Este tipo de células también se desarrollan en el hígado fetal y por ello se pueden tratar niños con inmunodeficiencias congénitas (Touraine J.L.,1980) suministrándoles estas células. La diferenciación de un célula madre pluripotente a una línea celular madura de la sangre responde a una variedad de factores de crecimiento (Müller-Sieburg C.E., et al., 1988); y la expansión de progenitores hematopoyéticos se usa también para suplementar los transplantes autólogos (Brugger W., et al., 1993).
Diversos experimentos demuestran la posibilidad de reprogramar células madre de tejidos adultos, que pueden inyectarse en distintos órganos, como corazón, músculos, hígado, pulmón o intestino, transformándose in situ en células de esos tejidos. Así se ha comprobado (Alison M.R., et al., 2000; Alison M.R., et al., 1998) que células madre de médula ósea no sólo se pueden transformar en células hepáticas, sino que en experimentos realizadas en ratones (Pedersen R.A., 1999) estas células madre pueden transformarse en células hepáticas, que en principio podrían ser útiles para tratamiento de enfermedades hepáticas degenerativas.
Se ha demostrado que las células troncales de la medula ósea de adulto pueden inyectarse en sangre y de allí migran al cerebro, se incorporan al tejido cerebral diferenciándose y se diferencian a neuronas con expresión de proteínas propias de estas células; esta enorme plasticidad supone un potencial de aplicaciones clínicas como fuente alternativa de neuronas para pacientes con enfermedad neurodegenerativa del sistema nervioso ( Mezey E., et al., 2000). Y Paul Sanberg presentó en febrero de 2000, en la Reunión Anual de la Asociación Americana para el Avance de las Ciencias experimentos que demuestran que es posible regenerar tejido nervioso deteriorado por un ictus cuando células de cordón umbilical se inyectan en la sangre de los animales lesionados (Zigova T., et al., 2001).
También se ha conseguido regenerar células cardiacas en el miocardio lesionado de ratones trasplantándoles células madre de médula ósea (Clarke, D.L., et al., 2000). Inyectadas directamente al corazón, o sencillamente a la circulación, no sólo se convierten en músculo cardiaco sino que se integran lentamente y llegan a ser indistinguibles y funcionales.
En resumen, la disyuntiva presentada a los investigadores, a las empresas y gobiernos, acerca de promover o por el contrario rechazar el uso y manipulación de embriones o de fetos humanos para obtener células madre pluripotentes puede ser bien resuelta acudiendo a las células madre de la sangre del cordón umbilical y a las multipotenciales de la médula ósea. La capacidad de crecimiento y la capacidad de diferenciarse a múltiples tipos de las primeras las hace muy difícilmente controlables para sustituir a las células dañadas o perdidas de un tejido concreto.
_____________________________
Bibliografía (III)
Anderson, K.C., Barut, B.A., Ritz, J. et al. Monoclonal antibody-purged autologous bone marrow transplantation therapy for multiple myeloma. Blood 1991; 77:712-720.
Ascenzi A. Physiological relationship and pathological interferences between bone tissue and marrow. In: Bourne G.H., ed. The Biochemistry and Physiology of Bone. New York: Academic Press, 1976:403-445.
Bernstein, I.D., Andrews, R.G., Zsebo, K.M. Recombinant human stem cell factor enhances the formation of colonies by CD34+ and CD34+lin– cells, and the generation of colony-forming cell progency from CD34+lin– cells cultured with interleukin-3 (IL-3), granulocyte-macrophage colony-stimulating factor (GM-CSF), or granulocyte colony stimulating factor (G-CSF). Blood 1991;77:2316-2321.
Bianco, P., Riminucci, M., Gronthos S., Robey, P.G. Bone marrow stromal stem cells: Nature, Biology, and Potential Applications. STEM CELLS 2001; 19:180-192.
Brazelton, T.R. et al. From marrow to brain: expression of neuronal phenotypes in adult mice. Science 2000; 290:1775-1779.
Broxmeyer, H.E., Douglas, G.W., Hangoc, G. et al. Human umbilical cord blood as a potential source of transplantable hematopoietic stem/progenitor cells. Proc. Natl. Acad. Sci. USA 1989; 86:3828-3832.
Bruder, S.P., Kraus, K.H., Goldberg, V.M. et al. The effect of implants loaded with autologous mesenchymal stem cells on the healing of canine segmental bone defects. J. Bone Joint Surg. Am. 1998; 80:985-996.
Campos, L., Bastion, Y., Roubi, N. et al. Peripheral blood stem cells harvested after chemotherapy and GM-CSF for treatment intensification in patients with advanced lymphoproliferative diseases. Leukemia 1993; 7:1409-1415.
Deeg, H.J., Klingemann, H.G., Phillips, G.L. A guide to bone marrow transplantation. Berlin, New York: Springer Verlag, 1988..
Ferrari, G., Cusella-De Angelis, G., Coletta, M. et al. Muscle regeneration by bone marrow-derived myogenic progenitors. Science 1998; 279:1528-1530.
Gazit, D., Turgeman, G., Kelley, P. et al. Engineered pluripotent mesenchymal cells integrate and differentiate in regenerating bone: a novel cell-mediated gene therapy. J. Gene Med. 1999;1:121-133.
Gluckman, E. Umbilical cord blood bank for transplantation of hematopoietic stem cells in man. Nouv. Rev. Fr. Hematol. 1993;35:293-294.
Gluckman, E., Broxmeyer, H.E., Auerbach, A.D. et al. Hematopoietic reconstitution in a patient with Fanconi"s anemia by means of umbilical-cord blood from an HLA-identical sibling. N. Engl. J. Med. 1989;321:1174-1178.
Harris, D.T., Schumacher, M.J., Rychlik, S. et al. Collection, separation and cryopreservaton of umbilical cord blood for use in transplantation. Bone Marrow Transplant 1994;13:135-143.
Horwitz, E.M., Prockop, D.J., Fitzpatrick, L.A. et al. Transplantability and therapeutic effects of bone marrow derived mesenchymal cells in children with osteogenesis imperfecta. Nat. Med.1999;5:309-313.
Huss, R. CD34-negative stem cells as the earliest precursors of hematopoietic progeny. Exp. Hematol. 1998;26:1022-1023. Huss, R. Isolation of primary and immortalized CD34–hematopoietic and mesenchymal stem cells from various sources. STEM CELLS 2000; 18:1-9. Huss, R., Günther, W., Schumm, M. et al. CD34-negative hematopoietic stem cells isolated from human peripheral blood cells as ultimate precursors of hematopoietic progenitors. Infusionsther Transfusionsmed 1997;24:404-409. Huss, R., Lange, C., Weissinger, E.M. et al. Evidence of peripheral Blood-Derived, plastic-adherent CD34-/low hematopoyetic stem cells clones with mesenchymal stem cell characteristics. SETM CELLS 2000; 18:252-260.
Jacobson, L.O., Marks, E.K., Robson, M.J. et al. Effect of spleen protection on mortality following x-irradiation. J. Lab. Clin. Med. 1949; 34:1538-1543.
Kadiyala, S., Young, R.G., Thiede, M.A. et al. Culture expanded canine mesenchymal stem cells possess osteochondrogenic potential in vivo and in vitro. Cell Transplant 1997;6:125-134.
Kline, M. La sangre del cordón umbilical. Investigación y Ciencia, junio 2001:6-11.
Krebsbach, P.H., Mankani, M.H., Satomura, K. et al. Repair of craniotomy defects using bone marrow stromal cells. Transplantation 1998;66:1272-1278
Lorenz, E., Uphoff, D., Reid, T.R. et al. Modification of irradiation injury in mice and guinea pigs by bone marrow injections. J. Natl. Cancer Inst. 1951; 12:197-201.
Makino, S., Fukuda, K., Miyoshi, S. et al. Cardiomyocytes can be generated from marrow stromal cells in vitro. J. Clin. Invest. 1999; 103:697-705.
Mayani, H., Lannsdorp, P.M. Biology of human umbilical cord blood-derived hematopoietic stem/progenitor cells. STEM CELLS 1998; 16:153-165.
Mezey, E., Chandross, K.J., Harta, G. et al. Turning blood into brain: Cells bearing neuronal antigens generated in vivo from bone marrow. Science 2000; 290:1779-1782.
Petersen, B.E., Bowen, W.C., Patrene, K.D. et al. Bone marrow as a potential source of hepatic oval cells. Science 1999; 284:1168-1170.
Pittinger, M.F., Mackay, A.M., Beck, S.C. et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999; 284:318-321.
Sandmaier, B.M., Storb, R., Kinley, J. et al. Evidence of allogeneic stromal engraftment in the bone marrow using canine mesenchymal stem cells. Blood 1998;92:116.
Siena, S., Bregni, M., Brando, B. et al. Circulation of CD34+ hematopoietic stem cells in the peripheral blood of high-dose cyclophosphamide-treated patients: enhancement by intravenous recombinant human granulocyte-macrophage colony-stimulating factor. Blood 1989; 74:1905-1914.
Storms, R.W., Trujillo, A.P., Springer, J.B., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proc. Natl. Acad. Sci. U.S.A. 1999; 96:9118-9123.
Thomas, E.D., Storb, R., Clift, R.A. et al. Bone-marrow transplantation. N. Engl. J. Med. 1975; 292:832-843.
Till, J.E., McCulloch, E.A. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiat Res. 1961; 14:213-222.
Touraine, J.L. Transplantation of both fetal liver and thymus in severe combined immunodeficiencies: interaction between donor"s and recipient"s cells. In: Lucarelli G, Fliedner TM, Gale RP, eds. Fetal Liver Transplantation. Amsterdam: Excerpta Medica, 1980; 276-283.
Ziegler, B.L., Valtieri, M., Almeida Porada, G. et al. KDR receptor: a key marker defining hematopoietic stem cells. Science 1999; 285:1553-1558.
Zigova, T., Willing, A.E., Saporta, S. et al. Apoptosis in cultured hNT neurons. Brain. Res. Dev. Brain Res. 2001; 127:63-70.
Translate to English:
Click upon the flag
Traducir del inglés a otros idiomas:
Posibles comentarios al texto:
Si desea hacer algún comentario a este texto, vaya a "Home" y haga click en "Comment" del artículo correspondiente._____________________________
Imprimir el texto:
Envio de este texto por e-mail a otra persona:
Puede utilizar dos sistemas:
a) Si basta enviar la referencia (URL) del texto, pulse el icono del sobre (un poco más arriba, a la derecha) y rellene los datos en el formulario que aparecerá en la pantalla.
b) Si desea enviar como mensaje el propio texto -total o parcialmente- y no sólo la referencia, puede utilizar el siguiente sistema:
_____________________________
Ir a la página principal:
<< regresar a "Home"